 Werner Heisenberg (1901 - 1976)
Werner Heisenberg (1901 - 1976)Il Principio d'Indeterminazione
(Heisemberg, 1927)
 Werner Heisenberg (1901 - 1976)
Werner Heisenberg (1901 - 1976)
Prende lo spunto dalla critica ad una nozione fondamentale della fisica classica, quella di traiettoria di una particella. (linea matematica, priva di spessore, cui ci si può avvicinare riducendo gli errori sperimentali)
Microscopio quantistico ideale di Heisemberg
(da George Gamow,Trent'anni che sconvolsero la fisica, Ed.Zanichelli)
In una camera con il vuoto assoluto si spari con C una particella con velocità v e la si illumini con lampi di una lampadina L. Il Teodolite T osserverà e potrà registrare sulla retina o su di una lastra fotografica la luce riflessa dalla particella permettendo quindi di determinarne la posizione.
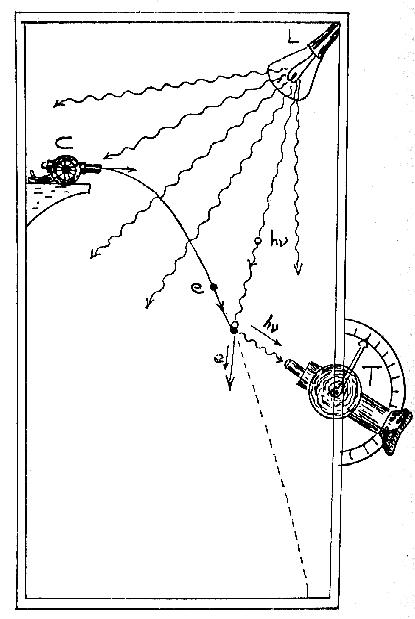
Classicamente:
Per ridurre l'errore nella determinazione della posizione di una particella si può ridurre quanto si vuole l'intensità della luce emessa da L, aumentando il n.° di lampi (10, 1000, 100000 osservazioni....) e la sensibilità di T.
L'immagine non può essere più piccola della lunghezza d'onda della radiazione usata , ma si può ridurre passando dalla luce visibile a quella U.V. , ai raggi X, e infine ai raggi g.
Non c'è limite alla precisione con la quale si può determinare la posizione della particella e quindi la sua traiettoria!
Quantisticamente ciò non è possibile!
Infatti:
Se si riduce n aumenta l (vn=c/l/) ma allora l'immagine è grande come tutta la camera !!
L'unica soluzione è un compromesso: Dx¿ l=c/n (indeterminazione sulla posizione)
Quindi: Dx·Dp¿ hn/c · c/n = h
Più precisamente: Dx·Dp Ø h/2p h (costante di Planck)=6.63 ·10-34 joule·s
Le deviazioni dalla meccanica classica, cioè l'incertezza nella contemporanea determinazione di velocità e posizione, sono importanti solo per masse piccolissime.
Ad esempio:
m= 1 mg Dv < 0.3 metri al secolo Dx ~ diametro nucleo atomico !!!
melettrone¿ 10-30 kg Se Dv < 0.2 ·106 m/s (10% della velocità) allora
Dx Ø 5 ·10-10 m cioè è dell'ordine delle dimensioni atomiche
Non ha dunque senso parlare di traiettorie dell'elettrone nè specificare dove si trova l'elettrone, ma solo valutare la probabilità che esso si trovi in quella 'zona' (vedi Meccanica Ondulatoria).
Lettura: Giulio Giorello, Scienza, la legge dell’incertezza
Approfondimenti su Heisemberg e il principio d'indeterminazione